Оглавление
- 1 Что такое апластическая анемия, как лечить?
- 2 Осложнения трансплантации костного мозга
- 3 Виды
- 4 Как проявляется заболевание в детском возрасте
- 5 Какими препаратами лечить апластическая анемия?
- 6 Лечение желудка и кишечника отваром овса
- 7 Механизм развития апластической анемии
- 8 Механизм развития апластической анемии
Что такое апластическая анемия, как лечить?
Несмотря на то, что под анемией принято подразумевать снижение концентрации эритроцитов иили
в периферической крови, в случае апластической анемии помимо описания эритроцитов необходимо кратко охарактеризовать
, поскольку при данном типе анемии происходит угнетение всех трех кроветворных ростков.
Эритроциты
Эритроциты, или красные кровяные тельца, являются наиболее многочисленными клетками крови. Они представляют собой безъядерные клетки в форме двояковогнутого диска. При рассмотрении под микроскопом они выглядят как круги с просветлением посередине. Существуют определенные показатели нормального состояния эритроцита.
Диаметр эритроцита находится в пределах 7,2 – 7,5 мкм. Увеличение или уменьшение диаметра может свидетельствовать в пользу определенных видов анемий. Присутствие в периферической крови эритроцитов с различным диаметром именуется анизоцитозом.Средний объем эритроцита равняется 90 мкм3. Длительность жизни эритроцита составляет 90 – 120 дней.
Особенности структуры эритроцитаВнутри эритроцита, а точнее, в ячейках цитоскелета (комплекс белков, обеспечивающих поддержание формы клетки) содержится вещество под названием гемоглобин. Подсчитано, что в одном эритроците может находиться от 280 до 400 миллионов молекул данного вещества. Гемоглобин представляет собой белковый комплекс, состоящий из белка глобина и гемма (сложная молекула, в центре которой располагается железо).
Основной функцией гемоглобина является перенос молекул кислорода к тканям и удаление из них углекислого газа. Существует несколько разновидностей гемоглобина (Hb). Гемоглобин А (HbA) является наиболее численной фракцией (95 – 98%) и представляет собой обычный гемоглобин, находящийся в кровеносной системе взрослого человека.
Гемоглобин А2 (HbA2) является структурной модификацией стандартного гемоглобина и отличается некоторыми особенностями, проявляющимися в неблагоприятных условиях среды. Его количество равно 2 – 3% от общего пула эритроцитов. Гемоглобин F (HbF) – фетальная фракция, у взрослых практически отсутствует (1 – 2%), однако превалирует у новорожденных детей (70 – 90%). К концу первого года жизни эритроциты, содержащие фетальный гемоглобин, разрушаются, а их место занимают эритроциты, заполненные взрослым HbA.
Мембрана эритроцита состоит из двойного слоя липидов, пронизанных белками, выполняющими функцию транспорта ионов и поддержания оптимального электролитного равновесия. На поверхности клеточной мембраны располагается особый слой гликопротеидов, называющийся гликокаликс. Различные молекулы, входящие в его состав, играют роль рецепторов и антигенов гистосовместимости, отличающих эритроцит от других клеток организма.
По приблизительным подсчетам на поверхности красных кровяных телец находится как минимум 250 видов различных антигенов, наиболее изученными из которых являются антигены системы АВ0 и резус-фактора. Согласно системе АВ0 эритроциты разделяются на 4 группы, а по резус-фактору различают две группы. Данные группы исключительно важны при переливании крови или эритроцитарной массы от доноров к реципиентам.
По системе АВ0 различают 4 группы крови:
- отсутствие агглютиногенов на поверхности эритроцитов;
- присутствие агглютиногенов А;
- присутствие агглютиногенов В;
- присутствие агглютиногенов А и В.
- резус-положительная (у 85% населения);
- резус-отрицательная (у 15 % населения).
Однако даже при переливании крови пациентам с одинаковой группой крови по обеим группам антигенов случаются анафилактические реакции. Данный феномен объясняется несовместимостью крови донора и реципиента по остальным типам антигенов. Учитывая различные комбинации между ними, вероятность переливания абсолютно идентичной группы крови ничтожно мала. Практически со стопроцентной вероятностью можно утверждать, что, сколько на планете людей, столько и групп крови.
Гликокаликс на поверхности мембраны здорового эритроцита имеет еще одну важную особенность – отрицательный заряд. Благодаря тому, что поверхность всех эритроцитов носит одинаковый заряд, согласно законам физики происходит их взаимное отталкивание. Более того, эндотелиоциты (клетки, выстилающие внутреннюю поверхность кровеносных сосудов) также обладают отрицательным зарядом.
Отличительной особенностью эритроцитов является их поразительная способность проникать через сосуды, диаметр которых менее диаметра эритроцита в 2 – 3 раза. С этой целью в процессе созревания эритроцита происходит разрушение его ядра и большинства органелл. Свойство эритроцита изменять свою форму называется деформируемостью и обеспечивается устойчивой работой цитоскелета клетки.
Цитоскелет является системой продольных внутриклеточных белков, которые, выстраиваясь определенным образом, придают клетке необходимую форму и способствуют ее активному передвижению. Основными структурами цитоскелета являются микротрубочки и микрофиламенты, а белки, из которых они состоят, называются актин, миозин и тубулин.
Однако в определенных случаях пластичность цитоскелета эритроцитов может ухудшаться, приводя к замедленному их прохождению по микроциркуляторному руслу и даже застреванию. При прохождении через селезенку эритроциты с пониженной деформируемостью задерживаются в ее сосудах и уничтожаются клетками макрофагальной системы.
Как и любая живая клетка, эритроцит нуждается в питательных веществах для поддержания работоспособности. Занимательно то, что клетки, переносящие кислород во все уголки тела человека, не нуждаются в нем и соответственно не потребляют его в процессе транспортировки. Образование молекул АТФ (аденозинтрифосфат), являющихся топливом для большинства ферментных систем клетки, происходит анаэробным, то есть безвоздушным путем. Таким образом, эритроциты абсолютно не чувствительны к недостатку кислорода, однако могут страдать от снижения уровня глюкозы в крови.
Помимо функции газообмена эритроциты выполняют еще ряд важных функций:
- поддержание кислотно-щелочного равновесия крови – посредством карбонатной буферной системы, второй по важности в организме.
- определение реологии крови – посредством изменения численности клеточных элементов крови по отношению к жидкой части.
- гемостаз – участие в образовании тромба в месте повреждения сосудистой стенки.
- участие в иммунных процессах – посредством специфических рецепторов к иммуноглобулинам и комплементу на мембране эритроцита.
Первичной клеткой, из которой происходит рост и дифференцировка эритроцита, является стволовая мультипотентная клетка. Из всех клеток организма она обладает наиболее высоким потенциалом к делению и самым широким спектром возможностей к дифференцировке. Иными словами, она является клеткой предшественницей всех тканей организма, и поэтому уровень ее дифференцированности приравнивается к нулевому.

При стимуляции малоизученными наукой медиаторами данная клетка трансформируется в тотипотентные клетки, способность которых к размножению также велика, а уровень дифференцированности выше. Впоследствии при дальнейшей дифференцировке тотипотентной клетки образуется колониеобразующая единица эритроцитарного ряда, иначе именуемая эритроцитарным ростком, являющимся непосредственным и первым предшественником красных кровяных телец.
По мере созревания клетки состав ее органелл значительно изменяется, среда из кислой становится нейтральной, а затем щелочной. Эти изменения соответствуют стадиям проэритробласта и эритробласта. Непосредственным предшественником эритроцита является ретикулоцит. Данная клетка в начале своего развития располагается в костном мозге в течение 24 – 30 часов, после чего выходит в кровеносное русло и дозревает в течение 36 – 44 часов.
Отличительной особенностью данных клеток является больший размер по сравнению с эритроцитом, скопления распавшегося ядра в виде небольших включений, незначительная сине-фиолетовая исчерченность. По мере полного созревания ретикулоцита его размер уменьшается за счет удаления из клетки остатков ядра и органелл, связанных с синтезом веществ.
Освободившееся место занимается молекулами гемоглобина, располагающимися в ячейках цитоскелета. В сформировавшемся эритроците еще в течение некоторого времени происходит синтез гемоглобина из остаточных цепей матричной РНК. По мере ее распада все синтетические процессы замирают, и эритроцит переходит в режим полноценной работы и параллельного поддержания жизнеспособности.
Регуляция роста и дифференцировки всех клеток эритроидного ряда осуществляется при непосредственном влиянии эритропоэтина. Данное вещество является одним из гормонов, синтезируемых почками. Точкой приложения его действия является проэритробласт. Регуляция осуществляется по механизму обратной связи. Иными словами, при снижении количества эритроцитов или гемоглобина в периферической крови происходит компенсаторный выброс эритропоэтина и наоборот – при высокой концентрации гемоглобина и эритроцитов образование эритропоэтина приостанавливается.
Эритропоэтин стимулирует рост, размножение и дифференцировку клеток эритроидного ряда, непосредственно воздействуя на них. Косвенная регуляция скорости эритропоэза (процесс образования эритроцитов в костном мозге) осуществляется посредством фактора стволовых клеток, интерлейкиа-3, витамина В12, микроэлементов (цинк, медь, железо, селен и др.), гормонов (соматостатин, тироксин, кортикостероиды и половые гормоны).
Осложнения трансплантации костного мозга
- инфекционные осложнения;
- реакция «трансплантат против организма хозяина»;
- реакция отторжения трансплантата;
- отказ жизненно важных органов.
Развитие осложнений такого рода характерно как для донора костного мозга, так и для пациента, которому он пересаживается. Нагноение послеоперационной раны у доноров развивается достаточно редко ввиду небольшого размера пункционных отверстий. Тем не менее, при попадании в них анаэробных бактерий существует риск развития тяжелого вторичного
. Инфекционные осложнения у реципиента костного мозга происходят по причине интенсивной иммуносупрессии, производящейся с целью успешного приживления стволовых клеток. На фоне снижения иммунитета присоединяются различные бактериальные инфекции, которые должны быть лечены высокими дозами антибиотиков широкого спектра.
Суть данного осложнения заключается в конфликте иммунных клеток организма хозяина со свежесформированными иммунными клетками донорских стволовых клеток. При этом донорские лимфоциты проявляют выраженную агрессию по отношению к лимфоцитам хозяина. Клинически это проявляется обильной
, кожными буллами, язвами, нарушением функций желудочно-кишечного тракта, сердечно-сосудистой системы и т. д.
Данное осложнение развивается исключительно при пересадке костного мозга или стволовых клеток от аллогенного донора. При пересадке собственных, замороженных ранее стволовых клеток, такое осложнение не развивается. Данное осложнение происходит при полной совместимости костного мозга донора и реципиента по всем 6 антигенам в 30% случаев.
При частичной совместимости риск такого осложнения возрастает до 80%. С целью профилактики данной патологической реакции применяются цитостатики. Наиболее часто препаратом выбора является циклоспорин А в паре с одним из следующих препаратов – метотрексат, имуран или глюкокортикоиды (дексаметазон, метилпреднизолон и др.)
Данное осложнение развивается, когда иммунная система организма хозяина определяет донорские стволовые клетки как угрозу и стремится их уничтожить. Оно характерно при пересадке донорских стволовых клеток. При пересадке собственных клеток такое осложнение исключается. У больных с апластической анемией реакция отторжения трансплантата развивается в 20% случаев, то есть у каждого пятого пациента. При подозрении на данный процесс вдобавок к кортикостероидам назначаются рекомбинантные факторы роста, увеличивающие темпы сращения тканей.
Трансплантация костного мозга является тяжелым испытанием для всех органов и систем организма. Высокие дозы медикаментов, в частности цитостатиков, оказывают разрушительное действие на ткани печени, почек, эндокринных желез и др. При истощении защитных резервов органов прекращается их функционирование. Наиболее часто наблюдается развитие острой
. Драматизм такого осложнения заключается в том, что в большинстве случаев единственным методом лечения является пересадка пораженных органов от доноров. Но ввиду того, что причина отказа органов не устранена, пересадку здорового органа осуществлять нельзя, так как он через короткое время таким же образом выйдет из строя.
Виды
Согласно МКБ 10-го пересмотра апластическая анемия входит в группу «другие анемии» под кодом D61.
В зависимости от клинической картины проявления заболевания различают:
- Наследственные апластические анемии. Данные патологии приводят к тотальному поражению системы кроветворения. Среди данного вида анемий выделяют два подвида:
- анемии Фанкони – если основное заболевание сопровождается формированием врожденных пороков развития;
- анемии Эстрена – Дамешека – если врожденные пороки отсутствуют;
- анемия Даймонда – Блекфена – форма анемии, при которой отмечается нарушение продукции только эритроцитарных клеток крови, обусловленное генетическими факторами.
- Приобретенные апластические (или гипопластические) анемии. Здесь также различают подвиды:
- формы анемий, которые характеризируются острым, подострым или хроническим процессом угнетения общего кроветворения;
- парциальная (красноклеточная) анемия – угнетается процесс формирования только эритроцитов.
Как проявляется заболевание в детском возрасте
В случае развития наследственных форм апластических анемий клиническая картина зависит от вида заболевания.
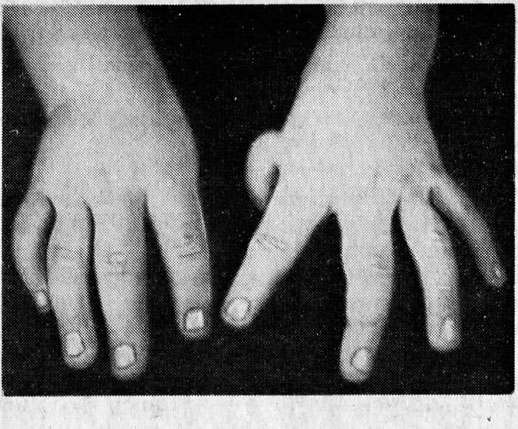
При диагностировании апластической анемии Фанкони у ребенка присутствуют такие врожденные пороки развития, как врожденные аномалии развития костной системы (отсутствие I пальца на кисти, искривление либо отсутствие лучевых костей и другие), пороки сердца и почек, аномалии развития глаз (маленькие глазные яблоки).
Симптомы апластической анемии у детей начинают появляться в возрасте 4 года, очень редко – в раннем возрасте. У ребенка наблюдается общая слабость, повышенная утомляемость, частые головные боли. Иммунитет снижается, ребенок становится более восприимчивым к простудным заболеваниям.
Геморрагический синдром проявляется склонностью к частым носовым кровотечениям. Лабораторное обследование дает характерную клиническую картину в анализах крови. Заболевание переходит в хроническую форму, прерываемую периодическими рецидивами.
Летальный исход при этой форме апластической анемии обусловлен присоединением инфекционного процесса или же развитием острой кровопотери из-за усилившегося геморрагического синдрома.
Случаи диагностирования апластической анемии Эстрена – Дамешека довольно редки. Данные виды болезни характеризируются нарушениями только кроветворных процессов.
При анемии Даймонда – Блекфена нарушаются процессы формирования только красных клеток крови. Геморрагический синдром отсутствует. При осмотре специалист отмечает бледность кожи, увеличение печени и спленомегалию. Концентрация тромбоцитов и лейкоцитов в крови может снизиться только в случае сильного поражения селезенки. Заболевание имеет хронически тяжелое течение. Прогноз крайне неблагоприятный. Смерть наступает до достижения 20-летнего возраста.
Какими препаратами лечить апластическая анемия?
Апластическая анемия – это комплекс клинических признаков со стороны костного мозга, связанные с угнетением его работоспособности. Результатом заболевания является недостаточная выработка кровяных элементов, что способствует развитию инфекционных процессов ввиду отсутствия защитного барьера со стороны кровеносной системы, а также к нарушению свертываемости крови и некоторым видам онкологии (лейкемия).
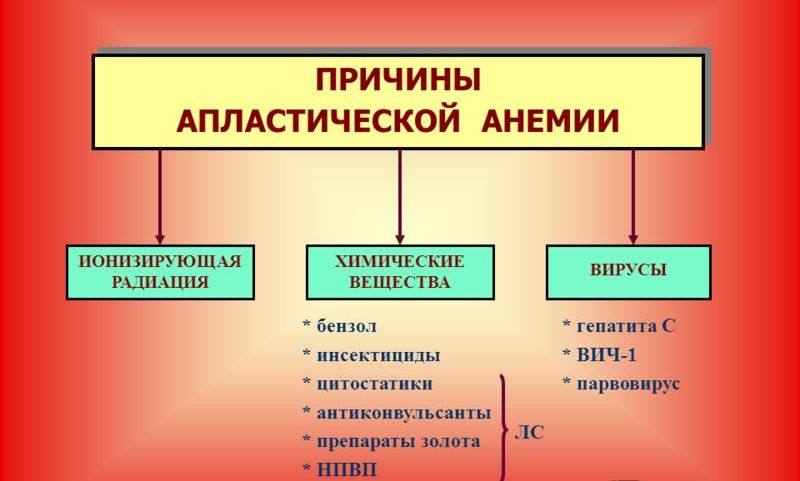
Апластические анемии могут быть как врожденные, так и приобретенные. Последние встречаются чаще первых и причиной их может стать действие радиации, вирусные гепатиты, прием некоторых препаратов (левомицетин, триметин, аминозин). Интересно, что чаще всего диагностируются идиопатические анемии данного типа – когда не удается выявить первопричину, несмотря на тщательное обследование.
Врожденные апластические анемии имеют несколько вариантов течения, которые были выделены в самостоятельные заболевания:
- Анемия Фанкони – редкий вид, отличительной особенностью является отсутствие или недоразвитие большого пальца верхних конечностей, наличие темных пятен на разных участках тела. Нередко протекает бессимптомно и диагностируется только на стадии онкологического процесса.
- Анемия Даймонда – Блекфена – проявляется нарушенной выработкой эритроцитов, лейкоциты и тромбоциты остаются при этом в норме. Способствует развитию онкологического процесса в области кишечника, костей или лейкемии.
- Синдром Шахмана – Дайдмонда – при данной патологии нарушается выработка и производительность лейкоцитов.
- Врожденный дискератоз – данным заболеванием чаще страдают мужчины, характеризуется дистрофией ногтевых пластин и пигментацией кожи (появление именно пятен).
- Пароксизмальная ночная гемоглобинурия – заболевание приобретенное, характеризуется недостаточной выработкой неполноценных эритроцитов, которые расцениваются организмом, как ненужные и уничтожаются. Заболевание характеризуется повышенной свертываемостью крови, слабостью, темной уриной.
- Дефицит эритроцитов: бледность, слабость, тошнота, шум в ушах.
- Дефицит лейкоцитов: снижение иммунитета, частые простуды, пневмонии, бронхиты, а также инфекции мочеполовой системы.
- Дефицит тромбоцитов: следы синяков после легкого прикосновения к чему-либо, носовые кровотечения, кровоточивость десен.
Основной причиной заболевания является нарушение работоспособности костного мозга. К основным факторам, которые ведут к данному процессу, можно отнести следующие:
- Действие радиоактивных лучей.
- Химиотерапия при лечении онкологии.
- Чрезмерное потребление продуктов, содержащих химические соединения (пестициды, реактивы и т.п.).
- Прием некоторых препаратов, в том числе и антибиотиков (в инструкции, как правило, указывают предупреждения).
- Беременность, на фоне которой могут возникать аутоиммунные изменения, которые также являются причиной анемии.
- Вирусные инфекции, особенно Цитомегаловирус, Эпштейна-Барр, Папилломавирус 19, ВИЧ.
Апластическая анемия и рак. Многие считают апластическую анемию онкологией, но это заблуждение, хотя оба вида заболевания тесно связаны друг с другом. Анемия данного типа является следствием нарушенного функционирования костного мозга, который в свою очередь прекращает адекватно производить кровяные клетки (тромбоциты, эритроциты, лейкоциты).
В результате этого происходят изменения в организме, особенно со стороны кровеносной системы, что приводит к развитию онкологии. Именно поэтому важно вовремя диагностировать заболевание, т.к. назначенное своевременно лечение может поддерживать длительный период ремиссии или способствовать выздоровлению (в редких случаях).
При первых подозрениях на апластическую анемию следует сдать общий клинический анализ крови – он продемонстрирует картину отклонения кровяных клеток от нормы.
Следующим этапом диагностики является биопсия костного мозга – подтверждением диагноза служит снижение количества кровяных клеток. Существуют и другие тесты, но их проводят после положительного результата предыдущих в качестве дополнительных мер.
Принципы лечения во многом зависят от степени развития заболевания и в некоторой степени от вида анемии. Самым эффективным способом лечения является пересадка костного мозга. Подобный метод считается эффективным даже при тяжелой форме течения, но главным условием успеха является совместимость костного мозга донора с реципиентом.
Переливание крови позволяет восполнить недостаток кровяных клеток, но этот метод лишь снимает симптоматику и дает временный результат.
Что касается препаратов, то медикаментозная терапия проводится с помощью иммунодепрессантов, которые в свою очередь подавляют защитные функции организма (иммунитет), тем самым активизируя естественную выработку клеток костным мозгом. В некоторых случаях совмещают стероидную терапию с указанной.

К препаратам иммуносупрессивной терапии (подавления) относятся антимоцитарные иммуноглобулины, циклоспорины и кортикостероиды. К первой группе медикаментов относится Атгам. Препарат выпускается в форме раствора для инфузий, назначают его чаще всего курсом от 8-ми до 14 дней, а далее продолжают через день в течение двух недель по одной дозе в качестве дополнительной терапии.
Следует учитывать, что данный иммунодепрессант подавляет продукцию тромбоцитов в значительной степени, поэтому вливание тромбоцитарной массы на фоне лечения является целесообразным. Лечение подобными видами препаратов производится в стационарных условиях под контролем лабораторных исследований.
Диета: долой жиры и простые углеводы. Специалисты рекомендуют поддерживать сбалансированный режим питания, исключая чрезмерный прием простых углеводов, жирной и жареной пищи. Коррекция питания во многом зависит от состояния больного и лабораторных данных. Употребление в пищу продуктов, богатых железом (гречка, гранат и т.д.) не является целесообразным, т.к. при некоторых видах апластической анемии наблюдается чрезмерное содержание железа в крови.
Лечение апластической анемии остается нерешенной проблемой, поскольку нет фундаментальных знаний о ее патогенезе, существует высокий риск фатальных осложнений лечения при тяжелых формах течения. Большинство современных методов лечения разработаны преимущественно на основании эмпирических результатов исследования.
Двумя ведущими направлениями в лечении апластической анемии являются мероприятия, направленные на восстановление костномозгового кроветворения и профилактики геморрагических и инфекционных осложнений и проявлений анемии. Лечение следует начинать немедленно после установления диагноза.
Использование циклоспорина А позволяет получить ответ почти у трети больных, рефрактерных к терапии антилимфоцитарным глобулином. Предполагают, что механизм действия циклоспорина А связан с необратимым и специфическим действием на геном стволовой клетки, с торможением апоптоза, угнетением продукции интерлейкина-2. Препарат не влияет на макрофагальное звено иммунитета и, как следствие, не уменьшает резистентность организма к инфекциям.

В течение первых 8-10 суток параллельно назначают антилимфоцитарный и антитромбоцитарный глобулин в виде длительной инфузии.
Из побочных эффектов применения указанных препаратов — высокая частота аллергических реакций немедленного (анафилактический шок) и замедленного (сывороточная болезнь, крапивница, миалгии, артралгии, гипертермия) типа.
Кортикоиды длительное время рассматривали как один из эффективных методов лечения апластической анемии. Однако доказано, что ремиссия после терапии кортикоидами наблюдается лишь у 12% пациентов, а комбинация кортикоидов с андрогенами не улучшает результатов лечения. Высокие дозы метилпреднизолона могут быть рекомендованы как альтернативная форма иммуносупрессивной терапии больных с тяжелым течением. Высокая частота осложнений не всегда позволяет его применять.
Сегодня трансплантация костного мозга — единственный радикальный метод лечения апластической анемии, поскольку в отдельных случаях может обеспечить восстановление нормального гемопоэза. Заместительную терапию компонентами крови проводят согласно обоснованным показаниями к ее назначению. Показания к трансфузии отмытых эритроцитов:
- уровень гемоглобина ниже 80 г/л;
- показатель гематокрита меньше 30%.
Угрозу системной или локальной инфекции определяют по уровню гранулоцитов. Фактором высокого риска возникновения инфекции следует считать уровень гранулоцитов ниже 0,2*10 9 /л, умеренного риска — уровень гранулоцитов 0,2-0,5*10 9 /л и низкого риска — более 0,5*10 9 /л. Для уменьшения риска кровоизлияний и местных воспалительных процессов внутримышечные и подкожные инъекции не проводят.
В случае возникновения лихорадки больным назначают эмпирическую антибактериальную терапию антибиотиками, прежде всего подавляют грамотрицательную микрофлору.
Использование андрогенов как самостоятельного метода лечения апластической анемии может быть оправданным при ее хроническом неагрессивном течении. Чаще всего применяют тестостерона пропионат, метилтестостерон, оксиметолон в начальной дозе 1-2 мг / кг массы те па в сутки. Лечение длится в среднем 1-3 мес. Спленэктомию как метод лечения апластической анемии последние годы почти не применяют.
Доза применяемого при лечении апластической анемии циклоспорина А колеблется в пределах 5-10 мг/кг массы тела в сутки в два употребления, ее регулируют по уровню креатинина в сыворотке крови. Продолжительность курса в среднем составляет 3-10 месяцев (но не менее 3 месяцев).
Антилимфоцитарный глобулин назначают в дозе 15 мг/кг массы тела в сутки в виде длительной, 8-12-часовой инфузии ежесуточно в течение 8-10 суток.
Антитромбоцитарный глобулин назначают в дозе 0,75 мг/кг массы тела в сутки в виде длительной, 4-5-часовой инфузии ежесуточно в течение 8-10 суток.
Лечение желудка и кишечника отваром овса
Лечение патологии довольно сложное. Оно может осуществляться консервативными или хирургическими методами. В первом случае прибегают к медикаментозной терапии, соблюдению диеты и общих рекомендаций.
В случае приобретенной апластической анемии пациента госпитализируют и обеспечивают полную изоляцию. Крайне важно создание антисептических условий, для чего необходимо принять определенные профилактические меры:
- ухаживать за полостью рта – применять четырежды в день дезинфицирующие растворы для полоскания (органический йод, хлоргексидин);
- тщательно ухаживать за зубами и деснами – обработка должна быть щадящей (только мягкие зубные щетки, если десна кровоточат – щетку исключают, делают полоскания);
- соблюдать гигиену кожи – ежедневно ходить в душ либо обтираться дезинфицирующим раствором (хлоргексидин), обрабатывать повреждения;
- исключить забор крови из пальца, внутримышечные инъекции;
- обеспечить строгую личную гигиену посетителей;
- персонал при входе в палату должен обрабатывать руки антисептиком.
Пациентам с апластической анемией необходимо вести правильный образ жизни. Он подразумевает периодическое прохождение профилактических обследований (в основном сдача анализов крови) и максимальное ограждение от негативных факторов.
На фоне апластической анемии иммунная система слаба, поэтому важно соблюдать следующие правила:
- избегание мест массового скопления людей;
- регулярное мытье рук;
- отказ от питания в сомнительных местах;
- исключение скоропортящихся продуктов (риск токсикоинфекций);
- санитарная обработка фруктов и овощей;
- правильная термическая обработка продуктов.
Пациентам с апластической анемией следует соблюдать активный образ жизни. Однако физические нагрузки должны быть дозированными, а занятия спортом ограничены. Это связано с высоким риском кровотечений и кровоизлияния.
При апластической анемии важно обеспечить сбалансированное питание. Пища должна приносить достаточное количество витаминов, минералов и белков. Это позволяет быстро восстановить кроветворение.
На время проведения иммуносупрессивной терапии с Циклоспорином A следует ограничить соль. Применение такого препарата подразумевает также исключение из питания грейпфрута и сока из него.
Первое время из-за риска инфекции необходимо обеспечить термическую обработку всех продуктов, включая фрукты и овощи. Огурцы из рациона надо исключить.
Следует минимизировать потребление твердой пищи и отказаться от орехов, сухарей и прочей подобной продукции из-за риска повреждения слизистых рта и пищевода с последующим кровотечением.
В качестве термической обработки предпочтительнее готовить пищу на пару. Важно исключить химикаты – газированные напитки, колбасу, чипсы, красители, ароматизаторы.
В рацион полезно включить красное мясо, гранаты, свеклу и сок из нее. Эффективно употребление лекарственных чаев, отваров и настоек на основе шиповника, ромашки, мяты, крапивы девясила. Применение таких средств необходимо согласовывать с лечащим врачом.
Особенности применения лекарственных препаратов при апластической анемии зависят от вызвавшей ее причины, проявлений болезни и возникших осложнений.
Основным медикаментом при такой патологии является Циклоспорин A. Этот иммунодепрессант минимизирует риск клональных заболеваний костного мозга.
В качестве иммуносупрессивной терапии Циклоспорин A может сочетаться с антитимоцитарным иммуноглобулином. Одновременно может быть проведена трансфузионная терапия и плазмаферез.
Эффективность иммуносупрессивной терапии составляет в среднем 70%. При отсутствии эффекта возможно проведение повторных курсов.
Медикаментозная терапия может включать следующие средства:
- Глюкокортикостероиды при аутоиммунном механизме заболевания и появлении антител к клеткам крови. Из числа таких препаратов часто назначают Метилпреднизолон. Его используют при введении антитимоцитарного иммуноглобулина, начиная принимать не позднее 2 недель после начала такой иммуносупрессивной терапии. Глюкокортикостероид в таком случае применяется для профилактики.
- Анаболические препараты для стимуляции кроветворения.
- Андрогены – анаболический эффект, стимуляция эритропоэза.
- Гликопротеиды – стимуляция пролиферации, дифференциация клеток-предшественниц гемопоэза (различные типы).
При лечении апластической анемии очень важно проводить профилактику различных инфекций. С этой целью могут быть использованы следующие медикаменты:
- Флюконазол или Позаконазол для предупреждения грибковых инфекций.
- Ко-тримоксазол (триметоприм/сульфометоксазол) для предупреждения пневомоцистной пневмонии. Такой препарат необходимо принимать в течение иммуносупрессивной терапии, до и после трансплантации костного мозга.
- Ацикловир – профилактика инфицирования вирусом простого герпеса. Возможно замещение Валацикловиром.
Данное мероприятие подразумевает переливание крови. Заместительная трансфузионная терапия предполагает применение эритроцитарной либо тромбоцитарной массы, а также их одновременного использования. Для расчета требуемого для переливания объема массы ориентируются на клинические проявления болезни и показатели периферической крови. В тяжелых случаях апластической анемии прибегают также к переливанию гранулоцитов.
Плазмаферез предполагает забор крови у пациента с последующей ее очисткой и возвращением обратно в кровоток.
Оперативное лечение обычно требуется при неэффективности консервативного подхода либо развитии серьезных осложнений.
Одной из возможных хирургических методик при апластической анемии является спленэктомия. Данная операция подразумевает удаление селезенки. Этот орган оказывает тормозящее влияние на кроветворение, поэтому его устранение позволяет улучшить гемопоэз.
Еще одно возможное направление в хирургическом лечении – трансплантация костного мозга. Такая операция возможна при наличии донора, отвечающего необходимым условиям. Для каждого четвертого пациента это братья либо сестры при условии совместимости по HLA. Менее 5% доноров находятся среди других близких родственников, существует возможность также использовать костный мозг абсолютно чужого человека – имеется Национальный регистр доноров костного мозга.
Недостаток трансплантации костного мозга заключается в наличии серьезных рисков. Они выражаются в возможности отторжения имплантата, реакции «трансплантат против хозяина».
Реабилитация после трансплантации в рамках стационара длится 1-2 месяца, а вернуться в состояние полной работоспособности перенесший ее человек сможет не ранее чем через год.
Если наступила полная или частичная ремиссия, то пациенту необходимо диспансерное наблюдение. С этой целью требуется регулярно посещать терапевта, а по возможности и гематолога.
Первый год осмотры следует проводить 1-2 раза в месяц, регулярность наблюдений в дальнейшем определяется в индивидуальном порядке, но должна составлять не менее одного раза в 3 месяца.
Диспансерное наблюдение предполагает регулярность лабораторных исследований. Преимущественно это анализы крови – общий клинический и биохимический. К пункции костного мозга прибегают строго по необходимости – подозрение на рецидив болезни или переход к острому миелоидному лейкозу.
Апластическая анемия — это заболевание крови. Оно характеризуется нарушением полноценного роста кровяных элементов в костном мозге. Именно он отвечает за продуцирование эритроцитов, лейкоцитов и тромбоцитов.

Чаще всего при этом недуге прогноз на выздоровление неблагоприятный. Как правило, речь идет о купировании неприятной симптоматики и облегчении страданий больного.
Среди основных факторов, повышающих вероятность благоприятного исхода, можно отметить:
- невысокую степень тяжести патологического процесса;
- грамотный подбор терапии и сопутствующих медикаментов;
- молодой возраст больного (чем младше пациент, тем выше у него шансы на полное излечение).
На вопрос о том, можно ли вылечить анемию апластическую, нельзя ответить однозначно. Все зависит от ряда факторов.
Апластическая анемия – это чаще приобретенное острое, подострое или хроническое заболевание системы крови, в основе которого лежит нарушение кроветворной функции костного мозга, а именно резкое снижение его способности вырабатывать клетки крови. Это тяжелое заболевание, приводящее даже к летальному исходу, к счастью, является редким. Вероятность заболеть у мужчин и у женщин примерно одинакова.
Лечение данного заболевания включает в себя 3 компонента: этиологический, патогенетический и симптоматический. Если известны причины, которые могли бы вызвать анемию (например, длительный контакт с инсектицидами), необходимо как можно быстрее устранить их – очень вероятно, что функция кроветворения после этого нормализуется.
Поскольку анемия, являющаяся обязательным признаком заболевания, приводит к серьезным нарушениям микроциркуляции в органах и тканях и к их кислородному голоданию, то необходимо стремиться нормализовать это звено: пациенту назначают переливания эритроцитарной массы, стремясь при этом к значению гемоглобина 80 г/л.

Ведущей причиной смерти лиц, страдающих апластической анемией, являются кровотечения. Чтобы устранить тромбоцитопению, пациенту должны быть назначены концентраты тромбоцитов – тромбомасса. Кроме того, чтобы не спровоцировать кровотечение, больным не рекомендуются физические нагрузки, запрещается прием аспирина и других противовоспалительных препаратов, женщинам следует принимать препараты, ингибирующие (подавляющие) овуляцию.
Сниженное количество лейкоцитов и нейтрофилов – лейкопения и нейтропения – являются третьим гематологическим признаком апластической анемии. Скорректировать уровень этих элементов в крови путем переливаний взвеси лейкоцитов невозможно, поскольку они циркулируют в организме лишь несколько часов, а затем погибают.
В данной ситуации на первый план выходят меры профилактики и своевременного лечения инфекционных заболеваний. С этой целью могут быть назначены антибактериальные (Норфлоксацин), противовирусные (Ацикловир) и противогрибковые (Флуконазол) препараты. Если на фоне указанной терапии температура тела больного не нормализуется, рекомендованы препараты, стимулирующие кроветворение.
- Кортикостероиды, или стероидные гормоны. Могут быть назначены лишь в сочетании с другими препаратами, изолированно не применяются, поскольку на фоне их приема повышается риск инфекционных осложнений.
- Андрогены. Широко используются в лечении апластических анемий. Эффект этих препаратов зависит от тяжести заболевания. Для достижения положительного результата необходим длительный непрерывный прием андрогенов – в течение нескольких месяцев и лет. В результате их приема снижается частота переливаний крови, улучшается качество жизни больных. Побочными эффектами являются поражение печени и вирилизация (появление мужских черт (оволосение, грубый тембр голоса) у женщин).
- Цитокины (КСФ-ГМ). Применение этих препаратов может частично скорректировать цитопению лишь в том случае, если не утрачена остаточная функция кроветворения (т. е. костный мозг работает, но очень слабо). Больший эффект от цитокинов отмечается после трансплантации костного мозга и применения препаратов, угнетающих иммунитет.
- Иммуносупрессоры (препараты, угнетающие иммунитет: Циклофосфамид, Циклоспорин и др.). Применение этих препаратов иногда приводит даже к полному восстановлению функции гемопоэза.
Механизм развития апластической анемии
На сегодняшний день в научном мире существуют несколько теорий, описывающих механизм развития апластической анемии. Занимательно то, что все теории являются полностью доказанными, и, тем не менее, не всегда могут объяснить угнетение костного мозга в том или ином конкретном случае.
Различают следующие теории патогенеза апластической анемии:
- стромальная;
- аутоиммунная;
- преждевременный апоптоз.
Доказано, что рост и созревание клеток костного мозга невозможен без влияния факторов, вырабатываемых стромой. Строма является скоплением соединительнотканных клеток, образующих своего рода «скелет» или «ложе» в котором залегают клетки костного мозга. Строма вырабатывает такие вещества как ИЛ (
) 1, 3 и 6 и фактор стволовых клеток. Данные вещества направляют развитие клеток предшественников в то или иное русло на различных стадиях их развития.
В 15 – 20% случаев апластических анемий причинной их развития становится недостаточное формирование и выделение стромальных факторов роста. По этой причине дифференцировка клеток крови останавливается на определенной стадии развития. В костном мозге при специальном исследовании можно обнаружить скопление предшественников клеток крови. В периферической крови отмечается увеличение эритропоэтина, который в норме влияет на строму костного мозга.
В биоптатах костного мозга в большинстве случаев обнаруживаются очаги скопления клеток Т-киллеров,
, фактора некроза опухолей альфа и гамма-интерферонов, указывающих на воспалительный механизм развития апластических анемий. При более детальном изучении клеток костномозговых ростков было обнаружено отсутствие на их поверхности определенного белково-углеводного комплекса, кодируемого геном PIG-A. Мутация данного гена приводит к отсутствию синтеза вышеуказанного комплекса. Вследствие этого не происходит инактивации системы комплемента – одного их звеньев иммунной защиты организма. В результате
воспринимает собственные клетки как чужеродные и стремится их уничтожить. Чем больше популяция мутировавших клеток по отношению к здоровым, тем более выражено нарушение синтеза клеток костного мозга.
Апоптоз является физиологическим процессом, при котором происходит самостоятельное разрушение клеток с определенными мутационными аномалиями или клеток, изживших отведенный им срок. Посредством апоптоза организм защищается от накопления мутаций и вызванных этим осложнений преимущественно опухолевого происхождения.
Несмотря на существование нескольких успешных теорий развития апластических анемий, в научном мире по-прежнему ведутся многочисленные исследования в данном направлении. Однако для практикующего врача, и тем более для пациента, поиск механизма, по которому происходит развитие заболевания, практически никогда не имеет смысла.
Это связано с тем, что на сегодняшний день не существует более или менее эффективных препаратов, помимо стероидных гормонов, способных замедлить прогрессию анемии или хотя бы частично ее компенсировать. К тому же, наиболее эффективным лечением сегодня является трансплантация костного мозга. Поэтому изучение механизма развития апластической анемии имеет исключительно научный интерес.
Как известно, кроветворение обеспечивается особой группой клеток – гемопоэтическими стволовыми клетками. Они обладают способностью размножаться и дифференцироваться в различные ростки кроветворения, из которых впоследствии образуются зрелые клетки крови – эритроциты, тромбоциты, лейкоциты и прочие. Под воздействием ряда внешних или внутренних факторов возможны следующие механизмы развития заболевания:
- уменьшается количество гемопоэтических стволовых клеток костного мозга;
- нарушается функция стволовых клеток, в результате чего не формируются зрелые форменные элементы крови.
Поражение стволовой клетки при данном заболевании подтверждается эффективностью трансплантации костного мозга от сестер или братьев, совместимых по HLA-системе или от однояйцевых близнецов. Трансплантированный костный мозг от однояйцевого близнеца не приживается в организме реципиента, если последний предварительно не получал курс препаратов, угнетающих иммунитет. Этот факт подтверждает иммунную природу апластической анемии.
Механизм развития апластической анемии
Причины апластической анемии в половине случаев остаются не выявленными. Развитие этой болезни связано с наличием экзогенных факторов, к которым можно отнести прием бензола, химиотерапию и противоопухолевое лечение. Заболевание возникает в результате воздействия иммунной системы на костный мозг, что препятствует воспроизведению клеток крови. Провокаторами апластической анемии может быть герпетическая инфекция, ВИЧ, вирусный гепатит.
Существуют следующие факторы риска, провоцирующие развитие апластической анемии:
- беременность
- вирусные инфекции
- большие дозы облучения и химиотерапии
- влияние токсинов, которые содержатся в краске и в бензине
- некоторые лекарственные препараты
- заболевание костного мозга
Современной медицине пока окончательно не известны механизмы и причины, которые приводят к формированию недоразвития костного мозга.
Выделяют несколько процессов развития апластической анемии:
- Развитие в организме процессов, приводящих к поражению стволовых клеток костного мозга.
- Действие защитных механизмов организма (клеточных, под влияние гормонов), в результате которого процессы образования клеток крови подавляются.
- Различные виды нарушений функционирования элементов микроокружения костного мозга (остеогенные, жировые клетки, макрофаги и другие).
- Недостаток в организме факторов, которые активизируют процессы кроветворения.
- Случаи, когда концентрация необходимых для кроветворения веществ сохраняется на должном уровне (в частности, железо в крови, витамин В12, протопорфирин), но они не усваиваются кроветворной тканью.
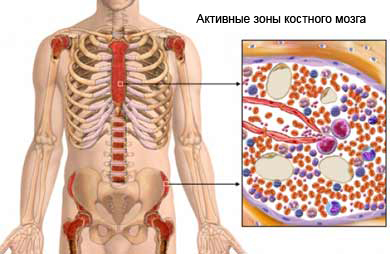
Заболевание анемии сопровождается нарушениями процессов выведения излишков железа, которое кумулируется в печени и селезенке.

Из-за понижения лейкоцитов в крови происходят сбои в работе иммунной системе организма. Снижением концентрации тромбоцитов в крови объясняется нарушение процессов свертываемости крови.
Повышение лимфоцитов, Отмечается «опустошение» костного мозга (панмиелофтиз).
Поскольку в крови снижается количество зрелых эритроцитов, это приводит к развитию хронической гипоксии в тканях, что влечет за собой дистрофические изменения внутренних органов. В первую очередь очень чувствительны к гипоксии (кислородное голодание) эндокринные железы.
